As enzimas são as potências da natureza. Encontrados nas células de todos os animais, plantas e todos os outros organismos vivos, eles aceleram as reações químicas que desencadeiam milhares de funções biológicas – da formação de neurônios à digestão de alimentos.
Eles realizam seus trabalhos de maneira tão seletiva e tão rápida – milhões de vezes mais rápida que um piscar de olhos – que o campo da química biomimética surgiu nas últimas décadas com o objetivo de projetar enzimas artificiais que possam imitar os poderes das enzimas naturais. configurações industriais. As enzimas artificiais podem, por exemplo, converter milho em etanol ou ajudar a criar novos medicamentos de maneira mais rápida, barata e eficaz.
Aproximando um passo para alcançar esse objetivo, Rajeev Prabhakar, químico da computação na Universidade de Miami, e seus colaboradores da Universidade de Michigan criaram uma nova molécula sintética de três fios que funciona exatamente como uma metaloenzima natural ou uma enzima que contém íons metálicos.
“Não estava claro que eles poderiam ser produzidos, mas nós os criamos. E então os usamos para catalisar reações com sucesso”, disse Prabhakar, professor de química que estuda reações enzimáticas na esperança de projetar seus análogos artificiais. “Este é um passo incremental, porém importante, no desenvolvimento de enzimas artificiais, que há muito é considerado o santo graal da química. Infelizmente, tão boas quanto as enzimas naturais funcionam em nossos corpos e outras formas de vida, elas não toleram muito bem outras configurações”. Eles também são muito caros e não são fáceis de preparar e purificar”.
Para seu estudo inovador publicado na revista Nature Chemistry nesta semana, Prabhakar e Vindi M. Jayasinghe-Arachchige uniram forças com Vincent L. Pecoraro, professor de química da Universidade de Michigan, para melhorar o desempenho das enzimas artificiais que o laboratório de Pecoraro foi pioneiro ao longo dos anos. Os pesquisadores de Michigan haviam criado anteriormente metaloenzimas sintéticas mais simples que catalisaram com sucesso várias reações químicas. Mas essas macromoléculas artificiais foram projetadas com três fios “homotriméricos” idênticos ou simétricos que, segundo Prabhakar, limitavam suas habilidades catalíticas.
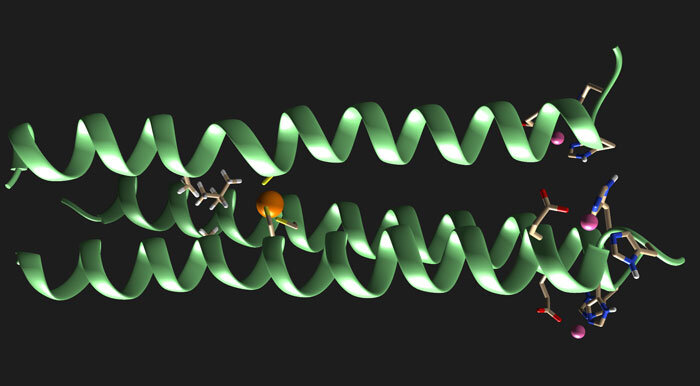
Na nova molécula, que Jayasinghe-Arachchige projetou no supercomputador da Universidade de Miami com a orientação de Prabhakar, a terceira cadeia difere em estrutura das outras duas cadeias. Seus cálculos da mecânica quântica mostraram que a estrutura mais complexa, não simétrica e de três fios, conhecida como bobina “heterotrimérica”, expandiu o desempenho catalítico de metaloenzimas artificiais homotriméricas – uma descoberta que Pecoraro e sua equipe confirmaram com experimentos em seu laboratório em Michigan.
“Nossas técnicas são diferentes, mas complementares”, disse Prabhakar. “O que fazemos, o grupo Pecoraro não pode fazer, e o que eles fazem, não podemos fazer. Modelamos moléculas no computador para que possamos prever suas propriedades estruturais e o mecanismo de suas formações. Eles usam nossos modelos para construir a coisa real, e neste caso, esse é o primeiro exemplo de uma molécula heterotrimérica natural”.
A maioria dos leigos provavelmente consideraria o estudo tão incompreensível quanto seu título: “Bobinas helicoidais heteroméricas de três fios, projetadas usando uma estratégia mediada pelo modelo Pb (II) (Cys) 3”. Mas o resultado final, disse Prabhakar, é que a pesquisa colaborativa realizada em Miami e Michigan abre as portas para uma nova estratégia para alcançar a criação de enzimas artificiais que funcionam tão bem quanto as enzimas naturais.
Além de Pecocaro, Prabhakar e Jayasinghe-Arachchige, outros co-autores do estudo incluem o ex-aluno de Prabhakar, Thomas J. Paul, agora na Universidade de Michigan; Audrey E. Tolbert, Catherine S. Ervin e Kosh P. Neupane, também da Universidade de Michigan; e Leela Ruckthong, da Universidade de Tecnologia do rei Mongkut, na Tailândia.
Agora, em seu último ano de estudo para seu doutorado em química, Jayasinghe-Arachchige disse que continua fascinada pelos avanços nas técnicas de química computacional que lhe permitiram modelar as estruturas e reações químicas da nova molécula.
“Estou empolgado por nossas descobertas criarem novos caminhos para o desenvolvimento de enzimas artificiais eficientes que podem ser usadas para melhorar a qualidade de vida”, finaliza Jayasinghe-Arachchige.
Achou útil essa informação? Compartilhe com seus amigos! xD
Deixe-nos a sua opinião aqui nos comentários.


